”Designer drug”: Ecstasy, la nuova droga d’abuso
Dr.Vera Scalori, Dr. Maria Tilde Torracca, Dr. Carla Pardini (Istituto di Farmacologia, Universita’ degli Studi di Pisa)
Introduzione Gli effetti dell’ecstasy sono attribuiti a modificazioni della funzione e dell’integrita’ del sistema serotoninergico. Essa aumenta il release di serotonina (5-HT), neurotrasmettitore deputato al controllo del sonno, del tono dell’umore, del comportamento sessuale e della fame. Studi sull’animale hanno infatti dimostrato che 1’MDMA agisce sul sistema serotoninergico come potente agente relisante la serotonina, sia ”in vivo” dopo singola (5) o multiple (è) somministrazioni, sia ”in vitro”, utilizzando ”slices” striatali di ratto. Tale effetto è il risultato di una serie di alterazioni che l’MDMA produce a livello del terminale serotoninergico quali: – blocco a livello del terminale presinaptico del carrier vescicolare deputato al trasporto di serotonina all’interno delle vescicole; – inversione del trasporto della serotonina da parte del carrier di membrana per accumulo del neurotrasmettitore nel citoplasma e quindi blocco del ”re-upfake”; - blocco delle mono aminoossidasi (MAO) di tipo A. Dopo 1’iniziale liberazione massiva di serotonina, 1’MDMA provoca un effetto opposto, poiché determina il blocco della sintesi di serotonina. Viene infatti inibito 1’enzima triptofano – idrossilasi deputato alla sintesi del neurotrasmettitore. Tale inibizione e ascrivibile ai seguenti fattori: - meccanismo a feed-back negativo prodotto da un accumulo di serotonina; - legame irreversibile all’enzima di un metabolita dell’MDMA di tipo chinoide altamente reattivo; formazione di radicali liberi durante il metabolismo dell’MDMA che inattiverebbero 1’enzima e sarebbero responsabili della neurotossicita’ (7). E’ stato osservato che una singola iniezione di MDMA (10 mg/kg) produce nel ratto una deplezione di serotonina caratterizzata da un andamento bifasico (8): nella prima fase, immediatamente dopo la somministrazione della sostanza, si osserva un rapido decremento nella concentrazione corticale di serotonina che risulta, dopo tre ore, ridotta al 16 % rispetto ai controlli. Questo effetto è attribuito ad un incremento del ”release” di serotonina, carrier vescicolare mediato, ritenuto responsabile degli effetti comportamentali della droga. Questa prima fase è definita fase acuta o reversibile, in quanto fra le è e le 24 ore successive al trattamento si ha un veloce ripristino dei livelli di serotonina. Nella seconda fase, ovvero nella settimana successiva, si verifica una nuova diminuzione dei livelli di questo neurotrasmettitore (74% rispetto ai controlli). Questa seconda fase è definita fase a lungo termine o neurotossica. Queste due fasi sembrano essere indipendenti 1’una dall’altra e ciò è stato provato analizzando gli effetti della fluoxetina sulla deplezione a lungo termine indotta da MDMA. La fluoxetina e un inibitore selettivo del ”re-uptake” della serotonina. Somministrando insieme MDMA e fluoxetina e sacrificando i ratti una settimana dopo, non si ha nessuna riduzione della concentrazione corticale di serotonina (5). La fluoxetina, quindi, protegge dalla tossicita’ da MDMA. L’aspetto più interessante e che si riesce ad avere protezione dalla deplezione cronica anche somministrando la fluoxetina tre ore dopo 1’MDMA, quando cioè si è gih avuta la fase acuta di deplezione di serotonina. L’azione protettiva diminuisce all’aumentare del tempo che intercorre tra la somministrazione di MDMA e quella di fluoxetina; con un intervallo di 12 ore non si ha più protezione . Oltre a confermare che fase acuta e fase neurotossica sono indipendenti, questi dati indicano che la fase neurotossica dipende da un qualche avvenimento che si verifica nelle 12 ore successive alla somministrazione della droga. Si pensa che questo evento sia rappresentato dall’effetto cumulativo tossico di un metabolita che viene trasportato all’interno dei terminali per mezzo del carrier per il ”re-uptake” di serotonina (5). Numerosi studi hanno evidenziato anche il coinvolgimento del rilascio di dopamina nel meccanismo di neurotossicita da MDMA (9;10) L’MDMA esplica la sua azione principalmente sul rilascio di serotonina, ma determina anche il rilascio di una certa quantith di dopamina. Questa azione è caratteristica dello stereoisomero (+), cosi come gli effetti neurotossici. Infatti, Hiramatsu e Cho (11) hanno verificato, tramite microdialisi, che il (-) MDMA non ha alcun effetto sull’ eHlusso di dopamina, mentre Schmidt et al. (10) hanno mostrato che solo lo stereoisomero (+) produce un innalzamento della concentrazione di dopamina. Yamamoto e Spanos (12) hanno osservato che, dopo tre ore dalla somministrazione di (+) MDMA, i livelli di dopamina extracellulari risultano il 200% rispetto ai controlli. Il ruolo della dopamina e stato specificamente confermato utilizzando a-metil- p-tirosina, un inibitore della biosintesi delle catecolamine in grado di ridurre i livelli di dopamina (13). La somministrazione di a-metil-p-tirosina tre ore prima del trattamento con MDMA o contemporaneamente ad essa, antagonizza la tossicità da MDMA. Se, al contrario, vengono innalzati i livelli di dopamina somministrando L-dopa, gli effetti neurofossici dell’MDMA risultano potenziati (10). Esperimenti condotti sul ratto hanno dimostrato che la somministrazione di MDMA aumenta 1’attività locomotoria, la frequenza cardiaca e la temperatura corporea (14), mentre nel cane e nella scimmia provoca una stimolazione simpaticomimetica con midriasi, salivazione, piloerezione ed ipertermia (15;16). L’ampiezza e la durata degli effetti dipendono dalla dose e dal numero di somministrazioni. Studi immunocitochimici nel ratto hanno confermato che 1’MDMA provoca degenerazione neuronale (17). Dopo 3è-48 ore dalla sua somministrazione sono visibili segni inequivocabili di degenerazione degli assoni che mostrano un aumento del calibro, con varicosita enormi e dilatate, frammentazione e monconi di assone dilatati. La perdita degli assoni serotoninergici, in analogia con la perdita di serotonina, risulta più marcata nella neocorteccia, nello striato e nel talamo. La perdita dei terminali serotoninergici e selettiva (17): infatti, mentre i sottili terminali serotoninergici che derivano dal nucIeo dorsale del rafe e che innervano la corteccia sono definitivamente persi dopo somministrazione della droga, gli assoni dotati di più ampie varicosita che provengono dal nucleo mediano del rafe sono risparmiati e non mostrano cambiamenti citopatologici. Gli effetti neurotossici, a differenza di quelli della fase acuta, sono caratteristici dello stereoisomero (+) MDMA. Mentre infatti, entrambi gli stereoisomeri (+) e (-) sono in grado di ridurre la concentrazione corticale di serotonina al 20% dei controlli dopo 3 ore dalla somministrazione, solo lo stereoisomero (+) produce una settimana dopo la somministrazione della droga . Questa diversità di risposta costituirebbe un’ ulteriore conferma dell’ipotesi secondo cui la fase acuta e la fase neurotossica sarebbero fenomeni indipendenti e la deplezione acuta di serotonina non sarebbe indispensabile alla risposta neurotossica (5). Sono stati eseguiti numerosi studi per valutare se si verifica una rigenerazione dei terminali serotoninergici a seguito della lesione. Nel ratto i neuroni serotoninergici possono rigenerare in quanto la MDMA distrugge gli assoni, ma risparmia i corpi cellulari. Studi immunocitochimici hanno evidenziato una graduale re-innervazione della corteccia e di altre strutture da parte degli assoni serotoninergici (18). La lesione del sistema serotoninergico indotta dalla somministrazione di dosi ripetute di 10-20 mg/kg regredisce dopo è mesi-un anno nel ratto (è), mentre gli effetti prodotti da alte dosi di MDMA nel primate non umano sono irreversibili (19). Non è ancora completamente accertato se 1’MDMA produca effetti neurotossici nell’uomo; esistono poche informazioni certe sull’uso di queste sostanze ed uno dei problemi connessi con 1’uso di MDMA sta nella difficoltà di dimostrare, cosi come e stato fatto per gli animali, gli eventuali effetti a lungo termine della droga sul sistema serotoninergico umano. Sono stati effettuati studi per verificare la potenziale neurotossicita dell’MDMA nell’uomo misurando i livelli di acido 5-idrossiindolacetico, un metabolita della serotonina, nel liquido cerebrospinale in un gruppo di consumatori di MDMA che avevano acconsentito a sottoporsi ad un prelievo lombare due o più settimane dopo 1’ultima assunzione di droga (20). I 33 soggetti presi in esame erano consumatori di MDMA in media da tre anni e mezzo, mentre la dose I dati ottenuti riguardo alla concentrazione di acido 5-idrossiindolacetico (metabolita della 5-HT), di acido omovanillico (metabolita della dopamina) e 3- metossi-4-idrossifenilglicol (metabolita della noradrenalina) nel liquido cerebrospinale prelevati nel gruppo in esame, sono stati paragonati a quelli ottenuti nel gruppo di controllo. Si osserva che, mentre le concentrazioni di acido omovanillico e 3-metossi-4-idrossifenilglicol non subiscono variazioni tra i due gruppi, il gruppo di consumatori di MDMA mostra una diminuzione del 26% nei livelli di acido 5-idrossiindolacetico. Anche se la causa di cioè non può essere identificata con certezza, risultati di studi su animali, roditori e primati, suggeriscono che possa essere coinvolto un danno agli assoni serotoninergici centrali. I risultati di questo studio, tuttavia, contrastano con quelli di uno studio precedente svolto da Peroutka (21) in cui i livelli di acido 5-idrossiindolacetico nel liquido cerebrospinale non risultavano alterati in cinque soggetti consumatori di MDMA. Certamente 1’uso dell’MDMA come droga ricreazionale pone crescenti problemi di salute pubblica. Esistono poche informazioni riguardo al numero di persone che hanno fatto uso della droga e ancora meno di quelle che continuano a farne. In un’ indagine informale in un campus universitario negli Stati Uniti risalente al 1987 (22) risultava che quasi il 40 % degli studenti aveva sperimentato ecstasy almeno una volta. In altre indagini la percentuale variava dal è al 25%. Nel 1985, Siegel (23) riportè che ogni mese, negli Stati Uniti, venivano vendute 30.000 dosi di MDMA. Più recentemente la stima è salita a 100.000 dosi ogni mese (24). Più noti sono gli effetti acuti che 1’MDMA provoca nell’uomo: e infatti ormai noto e descritto in letteratura che 1’assunzione di MDMA provoca aumento dell’attività fisica, aumento del tono dell’umore, effetto anoressizzante, associati ad un alterato senso della percezione, che si manifesta con sensazione di benessere e di amplificazione delle emozioni e dell’empatia. A questi effetti si alterazione della funzione vascolare, difficoltà respiratoria, rabdomiolisi e coagulazione intravascolare, con esiti a volte letali (25). Inoltre le condizioni ambientali in cui queste sostanze vengono assunte rendono particolarmente attiva questa droga e aumentano i suoi effetti tossici; questo fenomeno, comune a tutti gli anfetaminici, è noto con il nome di ”aggregation toxicity” o tossicità da raggruppamento. Studi su animali da laboratorio hanno infatti dimostrato che gli effetti tossici e comportamentali di queste sostanze sono estremamente potenziati se gli animali sono raggruppati insieme e tale effetto e stato confermato anche sull’uomo (4). E’ stato infatti osservato che nel determinismo delle patologie correlate all’assunzione di queste sostanze, quali per esempio 1’ipertemia maligna, acquisiscono importanza rilevante le condizioni in cui queste sostanze vengono assunte. Infatti, 1’aumento dell’attività’ fisica come ad esempio il ballo, la permanenza in ambienti surriscaldati come le discoteche, possono agire concausalmente con gli effetti farmacotossicodinamici (disidratazione da sudorazione profusa e diminuito apporto di liquidi per diminuzione del senso della sete) nel determinare la sregolazione del centro termoregolatore ipotalamico. Inoltre queste sostanze possono slatentizzare patologie preesistenti silenti, quali le miocardiopatie, le coronaropatie, le aritmie funzionali e 1’asma, patologie tutte correlabili ad un deficit basale di ossigenazione del muscolo cardiaco; gli anfetaminici agirebbero infatti attivando un effetto cardiotossico aritmogeno. Le conseguenze di questi effetti sono di estrema gravità e possono determinare la morte dell’individuo (25). Conclusioni L’assunzione di MDMA a scopo ricreativo pone fondamentalmente due tipi di problematiche, una relativa agli effetti osservati in acuto e 1’altra, estremamente complessa, riguardante gli effetti a lungo termine di un possibile danno neuronale. Il problema di tossicità acuta da MDMA è stato ed è ampiamente discusso ed evidenziato dalla stampa popolare, soprattutto in relazione ai numerosi decessi di individui in giovane età (morti del sabato sera). Va tuttavia ulteriormente sottolineato che 1’assunzione di questa droga, anche una sola volta la settimana, impedisce ai consumatori di riprendere il ritmo quotidiano delle proprie abitudini, sia scolastiche che di lavoro. Infatti in questi soggetti è rilevabile un’alterazione delle capacita decisionali, un diminuito desiderio di svolgere attività fisiche, difficoltà nell’eseguire operazioni matematiche, cui spesso si associano crisi di panico, insonnia, disorientamento e confusione (1). Meno noti ed analizzati dai massmedia risultano invece gli effetti a lungo termine di questa sostanza sui neuroni cerebrali. Infatti, sebbene non siano attualmente disponibili nella letteratura scientifica prove certe di un danno neuronale permanente nell’uomo, gli studi condotti sugli animali testimoniano inequivocabilmente che l’MDMA produce una distruzione a lungo termine degli assoni e dei terminali serotoninergici nel cervello. Questi effetti come e stato descritto, sarebbero lentamente reversibili nel ratto che pero' possiede, rispetto all’uomo, un sistema metabolico di gran lunga più efficace; le lesioni ottenute nei primati non umani, specie che più si avvicina all’uomo, non sarebbero invece in alcun modo reversibili. |
GARAU, L. Ecstasy: dall'uso in terapia all'abuso in discoteca. Medicina delle Tossicodipendenze, 1994; 4:34-43
SCHULGIN, A.T., NICHOLS D.E. Characterizationof three new psychotomimetics. In: The Psychopharmacology of hallucinogenes. Stillman, R., Willette, R., Eds. New York. Pergamon Press, 1978; pp 74-83
LAWN, J.C. Schedules of controlled sustances; scheduling of 3,4-methylendioxymethamphetamine (MDMA) into Schedule I of the controlled substances. Act. Federal Register, 1986;51:36552 - 36560.
HENRY, J.A. Ecstasy and new drugs of abuse. Corso di aggiornamento in tossicologia clinica: "Nuovi aspetti dell'emergenza tossicologica". Milano 11 aprile 1997. Abs. pg13
SCHIMDT, C.J. Neurotoxicity of the Psychedelic Amphetamine, Methilenedioxymethamphetamine. J. Pharmacol. Exp. Ther., 1986; 240: 1-6.
STONE, D.M. , STHAL, D.C., HANSON, G.R., GIBB, J.W.. The effects of 3,4-methylendioxymethamphetamine (MDMA) and 3,4-methylendioxyamphetamine (MDA) on monoaminergic systems in the rat brain. Eur. J. Pharmacol., 1986; 128: 41-48.
GESSA, G.L. Ecstasy: meccanismo d'azione e tossicità. Medicina delle tossicodipendenze, 1994; 4: 44-46.
SCHMIDT, C.J., LEVIN, J.A., LOVENBERG, W.. In vitro and in vivo neurochemical effects of methylendioxymethamphetamine on striatal monoaminergic systems in the rat brain. Biochem. Pharmacol. , 1987; 36: 747-755.
STONE, D.M., JOHNSON, M., HANSON, G.R., GIBB, J.W. . Role of endogenus dopamine in the central serotonergic deficits induced by 3,4-methylendioxymethamphetamine. J. Pharmacol. Exp. Ther., 1988; 247: 79-87.
SCHMIDT, C.J., BLACK, C.K., TAYLOR., V.L.. Antagonism of the neurotoxicity due to a single administration of methyilendioxy-methamphetamine. Eur. J. Pharmacol. , 1990; 181: 59-70.
HIRAMATSU, M.CHO. AK. Enantiomeric differences in the effects of 3, 4, methylendioxymethamphetamine on extracellular monoamines and metabolitesin the striatum of freely-moving rats: an in vivo microdialysis study.
Neuropharmacol. 1990; 29:269-275.
YAMAMOTO, B.K. SPANOS, L. J. The acute affect of methylendioxymethamphetamine on dopamine release in the awake- behaviorrat. Eur. J. Pharmacol. 1988; 148: 195-203
WAGNER, G.C. LUCOT, J. B. SCHUSTER, C.R. SEIDEN, LS. Alphamethyltyrosine attenuates and resepine potentiates methamphetamine induced neuronal changes. Soc.Neurosci. Abstr, 1982; 8: 488.
GORDON, C. J. WATKINSON, W.P. O' CALLAGHAN, J.P.MILLER, D.B. Effect of 3, 4 methylenedioxymethamphetamine on autonomic thermoregulatory responses of the rat. Pharmacol. Biochem. Behav. 1991; 38: 339-344
FRITH, CH, CHANG, L.W.LATTIN, DL, WALLS, RC, HAM, J. DOBLIN, R. Toxicity of 3,4 - methylendioxymethamphetamine on autonomic thermaregulatory responses of the rat. Pharmacol. Biochem. Behav, 1987; 38: 339 - 344.
HARDMAN, H.F, HAAVIK, C.O. SEEVERS, M.H. Relationship of the structure of mescaline and seven analogs to toxicity and behavior in five species of laboratory animals. Toxicol. Appl. Pharmacol, 1973; 25: 299 - 309
O' HEARN, E. BATTAGLIA, G, DE SOUZA, E.B.KUHAR, M.J. MOLLIVER, M.E. methylendioxyamphetamine (MDA) and methylendioxymethamphetamine (MDMA) cause selective ablation of serotonergic axon terninal in forebrian: Immunocytochemical evedence for neurotoxicity. J. Neurisci. 1988; 8:2788 - 2803
MOLLIVER, M.E., MAMONUNAS, L.A. CARR, P. Reinnervation of cerebral cortex by 5-HT axon after denervation by psychotropic amphetamine derivates. Soc. Neurosci. Abstr. 1989, 15: 417
RICAURTE, G.A. , MARTELLO, A.L. KATZ, J. L. , MARTELLO, M.B. Lasting effect of (+)3, 4 methylendioxymethamphetamine on central serotoninergic neurons in the primate: neurochemicl observations. J. Pharmacol Exp. Ther.1992; 261: 616-622.
RICAUTE, G.A.FINNEGAN, K.T. IRWIN, I,LANGSTON, J.W. Aminergic metabolis in cerebrospinal Fluid of Humans Previously Exposed to MDMA: preliminary observations. Ann. N. Y. Academy of sci. 1990; p. 699-710.
PEROUTKA, S.J. PASCOE, N, FAULL, F. Monoamine metabolites in the cerebrospinal fluid of recreational users of 3,4 methylendioxymethamphetamine (MDMA; "Ecstasy") Res. Commun. in. Substance Abuse, 1988; 8: 125-138.
PEROUTKA, SJ. Incidence of recreational use of (+_ )3,4- methylendioxymethamphetamine (Ecstasy) on an undergraduate campus. N.Engl. J. Med. 1987;317:1542-1543.
SIEGEL, R.K. Submitted as a preprint to the Drug Enforcement Agency for MDMA hearings, 1985.
DOBLIN, R. Risk assessment, the FDA and MDMA Research. In Ecstasy: The MDMA Story. B. Eisner, ED. Ronin Publishing, Inc., Berkeley, CA, 1989;pp.163-170.
MAROZZI, E . Tematiche di interesse tossicologico-forense in pronto soccorso. Corso di aggiornamento in tossicologia Clinica: "Nuovi aspetti dell'emergenza tossicologica" Milano 11 Aprile 1997. Abs. pg 23-26.
GREEN, AR, GOODWIN G.M. Ecstasy and neuridegeneration: ecstasy's long term effect are potentially more damaging than its acute toxicity. br. J Med. 1996; 312:1493.
Autoradiografia elaborata al computer che dimostra le alterazioni del metabolismo e delle funzioni delle strutture celebrali sotto l'effetto dell'ecstasy(MDMA).L'MDMA possiede una notevole azione perturbatrice delle strutture preposte all'attivazione cerebrale e del cervello emozionale
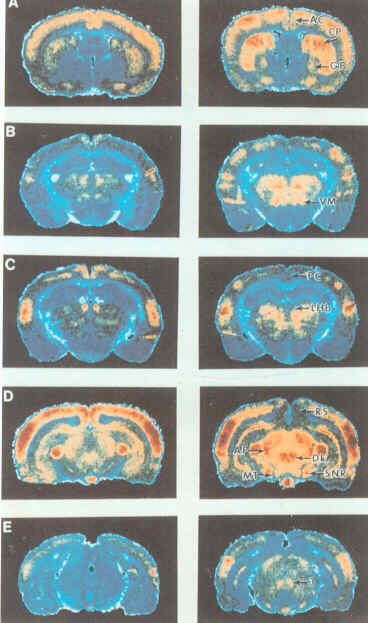
National Institute on Drug Abuse, Bethesda, USA
http://www.exodus.it/sostanze/ecstasy.htm![]()
http://www.lycaeum.org/languages/italian/e-l57.html![]()
http://www.geocities.com/SoHo/Square/8763/ecstasy.htm![]()
http://www.medol.com/mdt/speciali.html